代谢组学是众多组学的一种,是随着生命科学的发展而发展起来的。也是三大组学中,难度比较高的一个。今天汇总了代谢组学研究的一些基础知识,与小伙伴分享,希望能对你有所帮助。
代谢组学是目前关注度颇高的组学,第一,大家普遍认可代谢物反映生物表型和状态;第二,代谢物认为是功能分子,信号分子,其慢慢和功能相挂钩;第三,肠道微生物等新兴研究热点的带动。通过推测,代谢组学项目数量将慢慢赶上蛋白组学。
从基本组成来说,基因/转录组=测4种核苷酸序列;蛋白组=20种氨基酸排列;代谢组=测氨基酸+碳水化合物+有机酸+脂类等等,每一个分类都有N种。下图从四个方面,物质鉴定,分析体系,数据处理和数据挖掘来比较3大组学的优缺点。如图1

图1
从物质鉴定的数量来说,不同生物物种的代谢物数量多且差异较大。例如简单的拟南芥(Arabidopsis thaliana)能产生5000种以上的代谢物。个人认为三大组学中,代谢组学是难度比较高的一个。
一
代谢组学的研究方法
一般包括样品的采集和制备、代谢组学数据采集、数据预处理、多变量数据分析、生物标志物识别和途径分析等。如图2
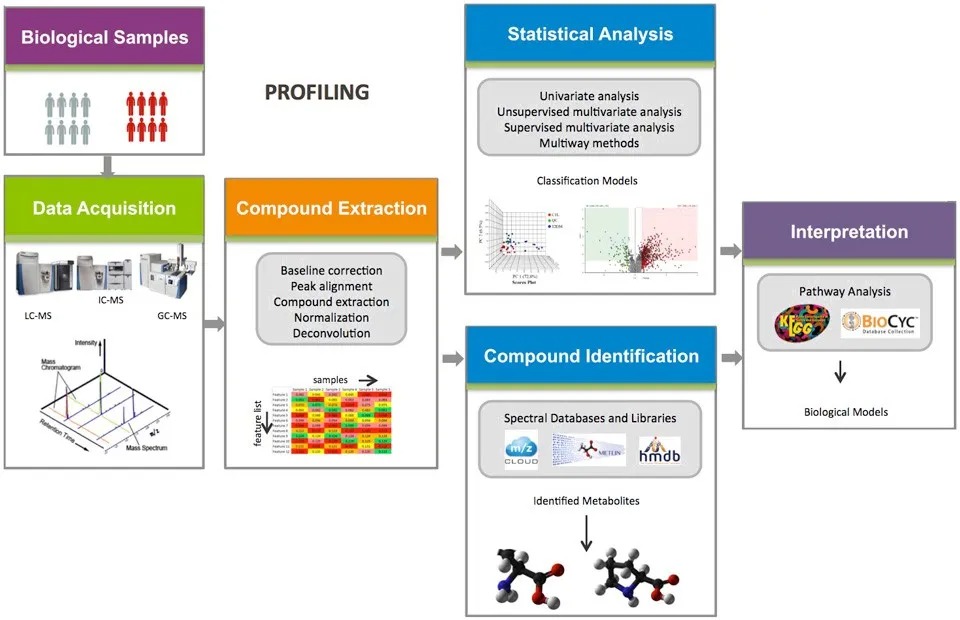
图2
1、样品的采集和制备
代谢组学研究需要严格的实验设计,首先需要采集足够数量的代表性样本,减少生物样品个体差异对分析结果的影响。一般来说,动物模型>10例,临床样本>30例,细胞>6例,植物昆虫微生物样本等>6-8例。图2展示的不同样品类型在LC-MS检测过程中,推荐的最低样本量以及保存方式。

图3
在预处理及保存过程中,需要快速处理样品,比如血清血浆的收集需要在1h内完成,避免出现溶血现象。由于代谢组学一次分析很多样本且一般不可能在一天内采集完成,所以样品需要提前液氮速冻后,保存在-80℃条件下。同时,样本不建议反复冻融,例如粪便/肠道内容物中有非常多微生物,其代谢速度很快,反复冻融会对代谢水平有很大影响。
二
代谢组学分析平台
图4
完成样本的采集和预处理之后,代谢产物需要通过合适的方法进行测定。代谢组学的研究中一般有色谱、质谱、NMR、毛细管电泳和红外光谱等分离方法,其中色谱-质谱联用(LC-MS和GC-MS)的方法兼具有色谱的高分析度,质谱的高灵敏度,应用范围较广;NMR例如1H-NMR对含氢代谢产物进行检测,能够完成样品中大多数化合物的检测。
1、核磁共振波谱(NMR)
核磁共振波谱(nuclear magnetic resonance,NMR)是一种基于具有自旋性质的原子核在核外磁场的作用下,吸收射频辐射而产生的能级跃迁谱学技术。其基本结构图如图2所示。根据NMR原理(感兴趣的读者可以自行知乎或者百度),射频频率有60MHz、100 MHz和600 MHz等;磁体类型有永磁、电磁和超导磁体等;仪器工作时可分为连续波和脉冲傅里叶变换核磁共振波谱仪,因为傅里叶变换检测的灵敏度更高,检测时间更短,所以已经替代了连续波波谱仪。
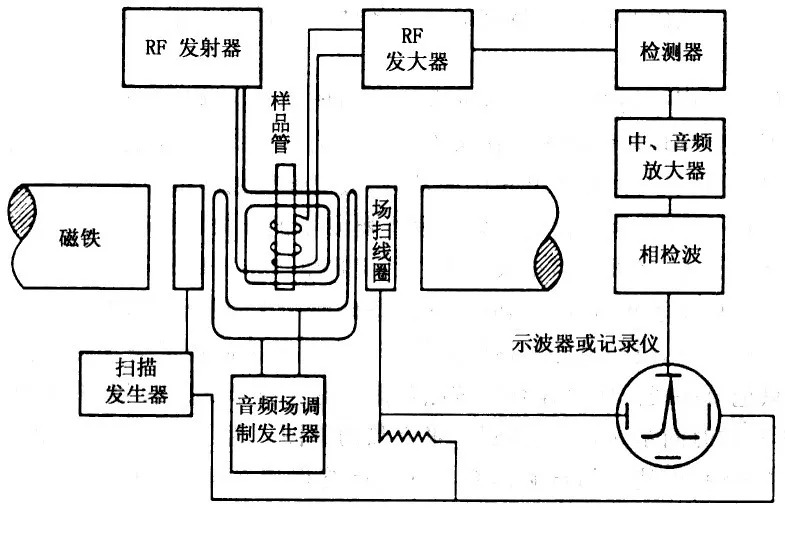
图5
NMR常被我们诟病的是它的灵敏度,低浓度的代谢物检测出来的概率较低。图2展示的是NMR和色谱质谱联用的灵敏度比较,从图6中可以看出,NMR最小检测浓度是uM级别,远低于色谱质谱联用的nM级别。
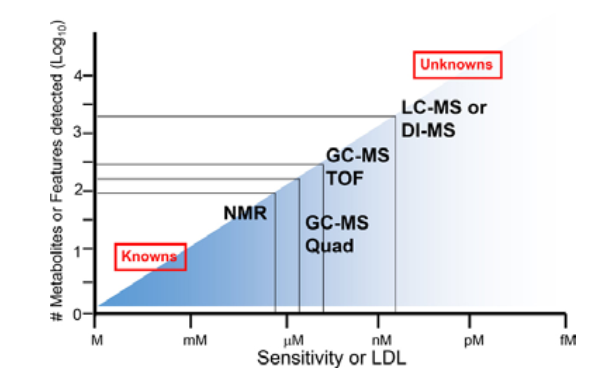
图6
NMR的优点非常适合无损采样,最小的样品制备以及同时检测具有不同的物理化学性质的代谢物。通常用于研究生物样本的核磁共振的活性核包括1H、13C、15N和31P。由于一维(1D)1H-NMR谱(氢谱)的高天然丰度(99.98%)和高的灵敏度(高磁旋比),其在代谢组学研究中应用较多。图4展示的是尿液和血浆样本氢谱图(500MHz),图中的每一个数字表示鉴定的一个代谢物。
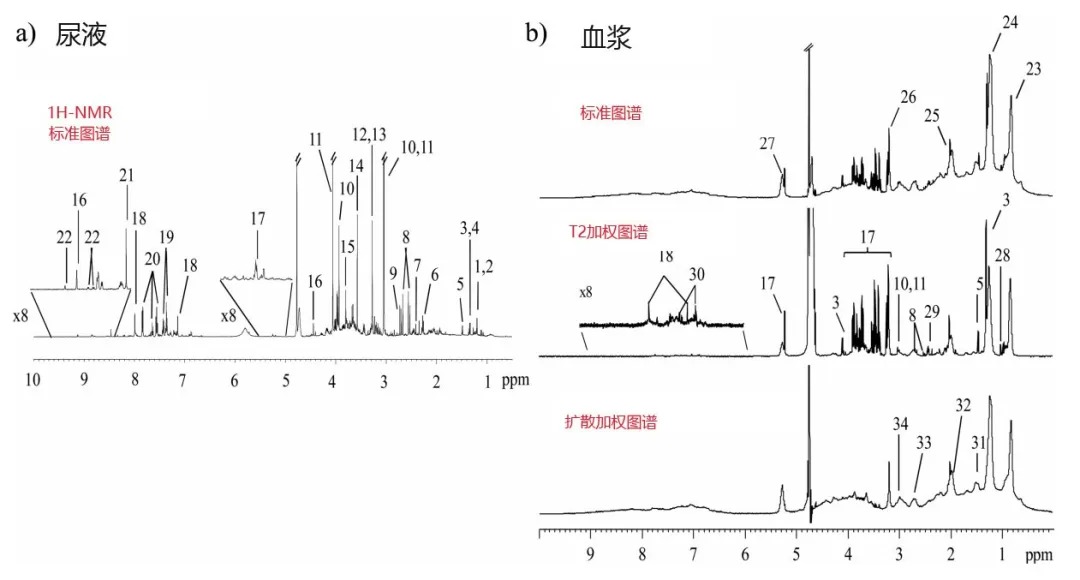
图7
2、气相色谱质谱联用技术(GC-MS)
气相色谱(GC)是以气体为流动相的色谱分析方法,适合于分离分析易气化、稳定、不易分解、不易反应的样品,特别适合同系物,同分异构体的分离。质谱法(MS)即用电场和磁场将运动的离子(带电荷的原子等)按它们的质荷比分离后进行检测的方法,其基本原理是样本进入质谱仪器,在质谱仪离子源中,化合物被电子轰击,电离成分子离子和碎片离子,这些离子在质量分析器中,按质荷比大小顺序分开,经过电子倍增器检测,即可得到化合物的质谱图。图8展示了气相的仪器组成。
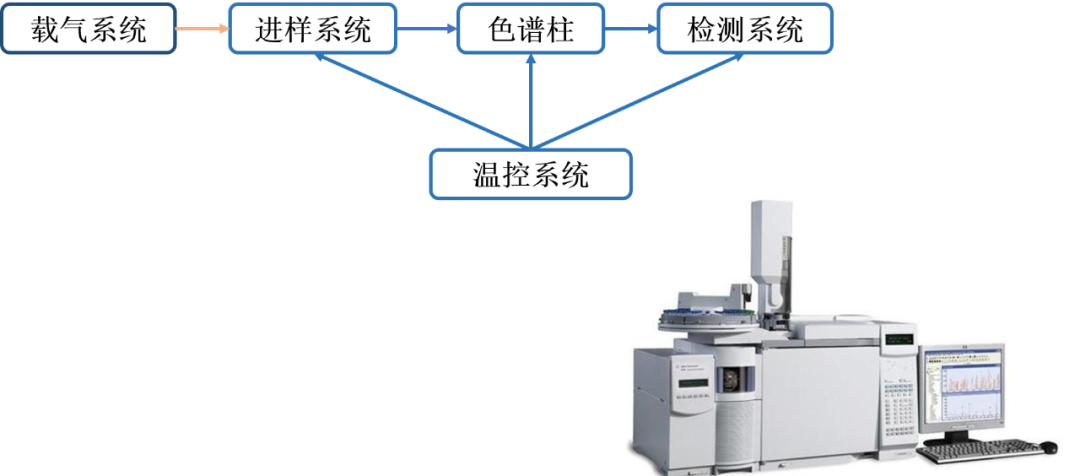
图8
色谱的特点是将复杂混合物分离成单一组分,但是定性结构能力较差;质谱等技术对一个纯组分结构确定更为容易,GC和MS的协同耦合使得串联技术成为代谢组学分析的一大主力,GC/MS是一个很好的工具可应用于大量代谢组学的分离、检测和定量,图9列出来了其优点和局限性。
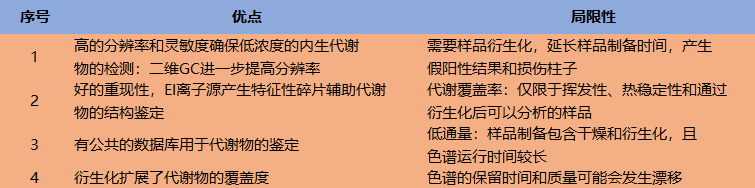
图9
GC-MS最让我们诟病的是需要对样本进行衍生化处理,这增加了样本制备的时间。GC-MS的优点是灵敏度高,在色谱的重复性、分辨率和电子轰击电离源得到的质谱碎片的重复性有明显优势,且受基体效应的影响较小。图10罗列了尿液样本的GC/TOFMS图。
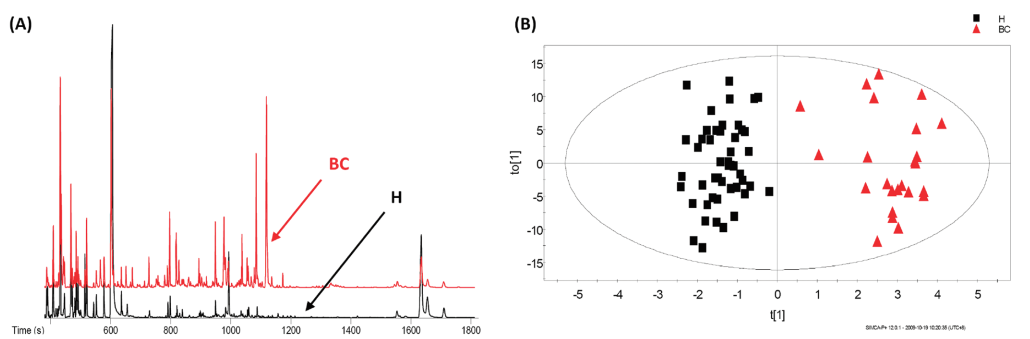
图10
3、液相色谱质谱联用技术(LC-MS)
高效液相色谱(HPLC)是以液体为流动相的色谱法,其基本原理是色谱过程中不同组分在相对运动,不相混溶的两相间进行交换,相对静止的一相为固定相,相对运动的相为固定相,利用吸附,分配,离子交换,亲和力或分子大小等性质的微小差别,经过连续多次在两相间进的质量交换,使不同组分得到分离。图11展示了LC-MS流程示意图。
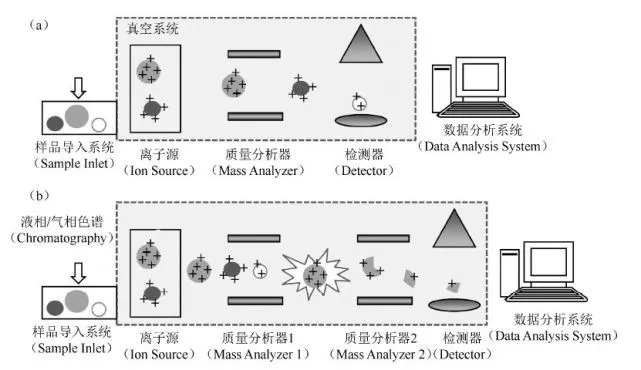
图11
液相质谱联用技术面临的问题是液相流动对质谱工作条件的影响,同时质谱离子源的温度对液相色谱分析源的影响。还有一个比较重要的一点,不同参数,不同仪器的液相质谱得出的数据都不完全相同,现阶段使用的数据库,更多的是自己建库或者解析图谱。
液相质谱常用的分类类型是常规梯度反相色谱(RPLC),RPLC的局限之一是分析极性/离子型代谢物,因为这些物质的保留性差,很容易洗脱,因此,RPLC适合中等极性或者非极性代谢物的分离。分析这些不保留的代谢物需要不同的策略,例如亲水性相互作用(HILIC)、离子对(IPLC)和离子交换(IEC)等,图12列出LC-MS能够检测的代谢物类型。
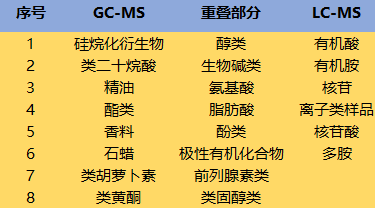
图12
近期离子迁移谱(ion mobility spectrometry,IMS)结合LC-MS相关的代谢组学文章也多有发表,IMS的核心原理是电场驱动下离子在气体阻尼环境中的迁移速率差异。IMS的这种机制以及提供分离作用,还可以确定分子的“碰撞截面”(CCS)。增加离子迁移能力的质谱仪,通过提供正交的分离尺寸,在MS检测之前分离具有不同CCS值的共洗脱代谢物,提高了光谱质量并帮助代谢物表征/鉴定。图13罗列出IMS和DIA分析数据鉴定代谢物的比较。
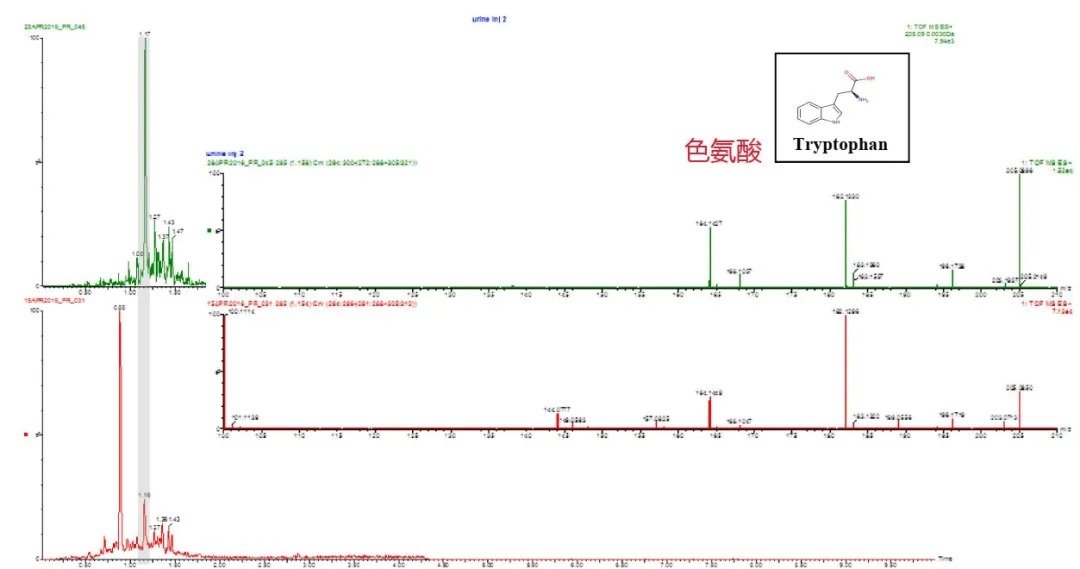
图13
从图中可以看出结合了IMS的质谱,显示的色氨酸光谱更清晰。
图14展示的是三大分析技术在检测过程中的优缺点。
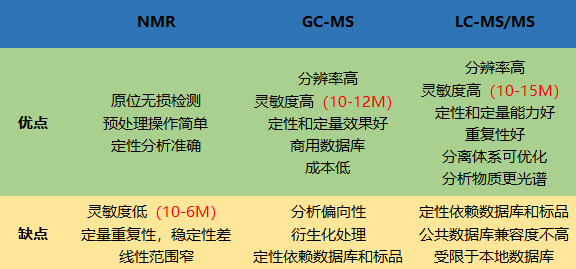
图14
因为LC-MS避免了GC-MS中繁杂的样品前处理,其较高的灵敏度和较宽的动态范围,已经被越来越多的用于代谢组学的研究,它非常适合生物样本中复杂代谢产物的检测。
三
生物体液样本的前处理方法
样品的前处理策略选择有助于给定实验的成功,因为其会影响观察到的代谢物图谱和数据的质量。在给定的研究中,样本制备方法的能力和局限会影响生物学解释的准确性。例如Xavier发表的关于不同萃取方法提取微生物代谢物,所得到的结果显示27个代谢通路中有17个通路显示出相反的上下调关系,表明随提取方法的不同数据会产生了相互矛盾,体现了代谢组学中样本制备方法的选择,对观察到的代谢物和准确的生物学解释,有较大的影响。本节罗列了5种样本前处理的技术以及发展趋势。图1所示合适的提取方法提取细胞样本的代谢物。
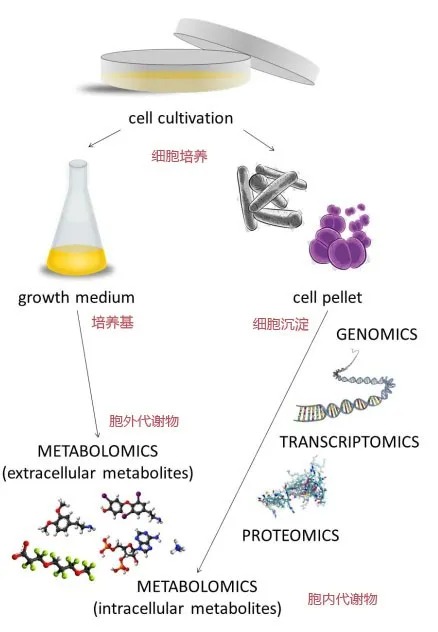
图15
1、样本前处理的理想状态
代谢组学样本前处理的理想状态如图2所示,其必须满足以下条件:1、非选择性;2、步骤少且快速;3、可重复;4、包含代谢终止过程。到目前为止还没有单一的前处理能够满足以上所有的需求。
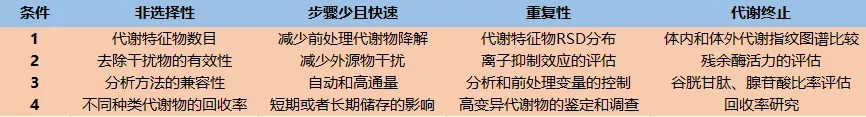
图16
从生物标志物发现的角度来看,最矛盾的需求之一是代谢终止,包括细胞,植物和组织的样本。代谢终止的目的是使用低温,加酸或者快速加热来阻止代谢过程,然而代谢过程是非常快的,往往具有小于1s的时间尺度,例如ATP,6-磷酸-葡萄糖和腺苷等。因此在适当的时间尺度内,可能非常难以实施适当的终止步骤,增加一个终止步骤可能导致无意降解或者某些代谢物的损失。例如,Deprez S发表的在冷藏的大鼠血浆中,残留的酶导致胆碱、甘油、酪氨酸和苯丙氨酸水平上升。
对于稳定的代谢物,代谢终止的意义不大;但是对于易于降解或者转化的不稳定代谢物,代谢终止的步骤很重要,虽然不稳定的代谢物所占的比例较低,但是也可能这些比例较低的代谢物正是重要的生物标志物,例如上面提到的腺苷以及谷胱甘肽等都被报道为癌症的生物标志物。因此,确定哪些代谢物并不会受到不同终止/存储条件的影响,对于代谢组学领域的成熟和生物标志物的发现,会有重要作用。
2、生物体液样本的前处理方法
(1)直接稀释进样
一般适用于尿液样本,典型的稀释比采用纯水稀释1:10倍。图17概括了尿液以及血浆等生物体液所推荐的LC-MS分析流程。
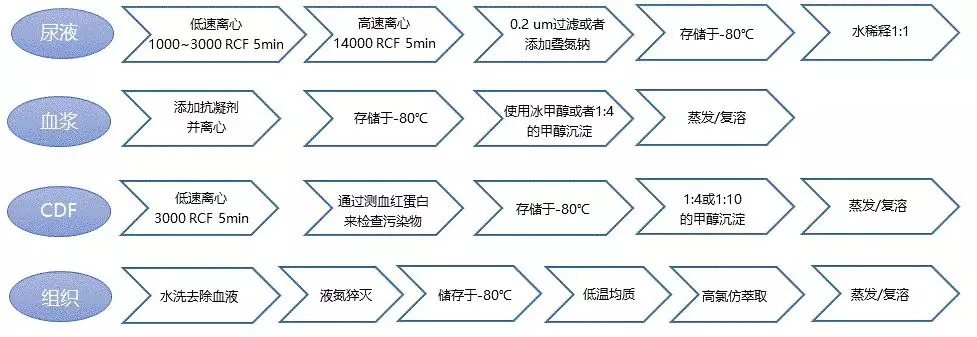
图17
(2)溶剂沉淀
在生物体液样本中例如血清,血浆等添加有机溶剂(甲醇、乙腈、乙醇、丙酮或其组合)能够去除蛋白质,破坏蛋白和代谢物之间的交联作用,由此获得的代谢物浓度代表总代谢物浓度。图18展示了14种提取方法的综合比较,通过分层聚类对不同溶剂提取代谢物的重复性进行比较,斜深色格子代表某一提取方法6次LC-MS至少5次检测的特征。
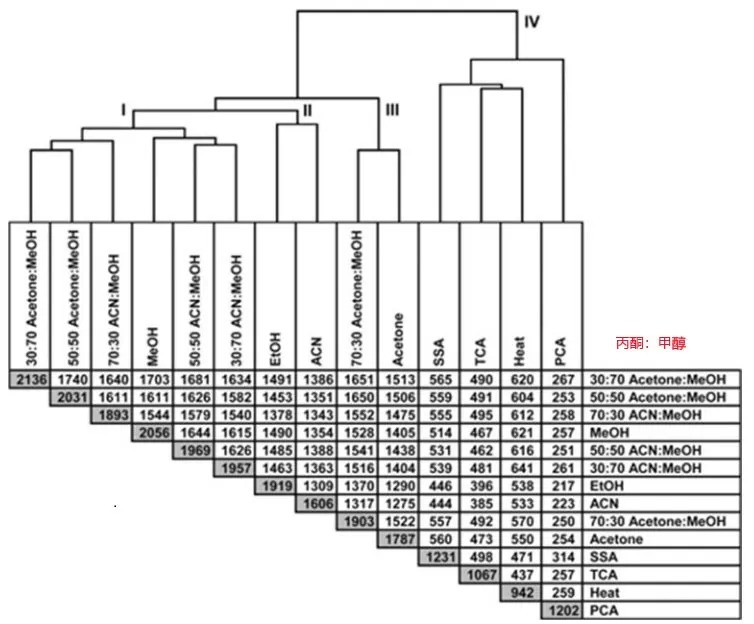
图18
从图中可以看出,丙酮/甲醇混合物和甲醇沉淀可以获得最佳的代谢物覆盖。
(3)超滤
超滤是一种常见的生物样品制备放方法,其根据分析物的分子质量来分离。例如3000Da的滤膜可以从蛋白质或者其他大分子中分离小分子质量的代谢物。然后,超滤对极性分子有一定的偏向性,和溶剂沉淀相比,会显著损失疏水性代谢物的种类。
(4)固相萃取(SPE)
SPE广泛应用于靶向的生物分析,步骤如下:1.分析物吸附在溶剂表面;2.通过淋洗去除比分析物吸附能力弱的干扰物;3.使用溶剂将分析物洗脱下来。例如我们所熟知的C18柱,现在C18和聚苯乙烯-二乙烯基苯吸附剂组合已经被用于非靶向相代谢组学研究。SPE 现在的困难点在设计通用的提取条件。
3、生物样本前处理发展趋势
(1)体内取样:固相微萃取(SPME)
活体取样避免了采样过程中,样品可能会暴露于氧、溶剂、pH条件下造成的代谢图谱变化,以及相应的各种生物过程被激活。SPEM技术能很好的平衡亲水和疏水代谢物的提取,这项技术可以应用于小鼠循环血液代谢物的活体取样。如图5(A)所示,吸附剂颗粒直接固定在金属线的外面,这个金属线可以容易的容纳在皮下注射针的内部。因为SPME所用的吸附剂对样本的比例很低,所以目标分析物数量不会很多。图19(B)是溶剂沉淀的流程图,举个例子,SPME(1868个代谢物)、溶剂沉淀血浆(3969个特征物质)和超滤(2262个特征物质)表明,SPME有很好的代谢覆盖率。这个方法的可以避免不良反应以及蛋白的吸附或者凝血现象的发生。
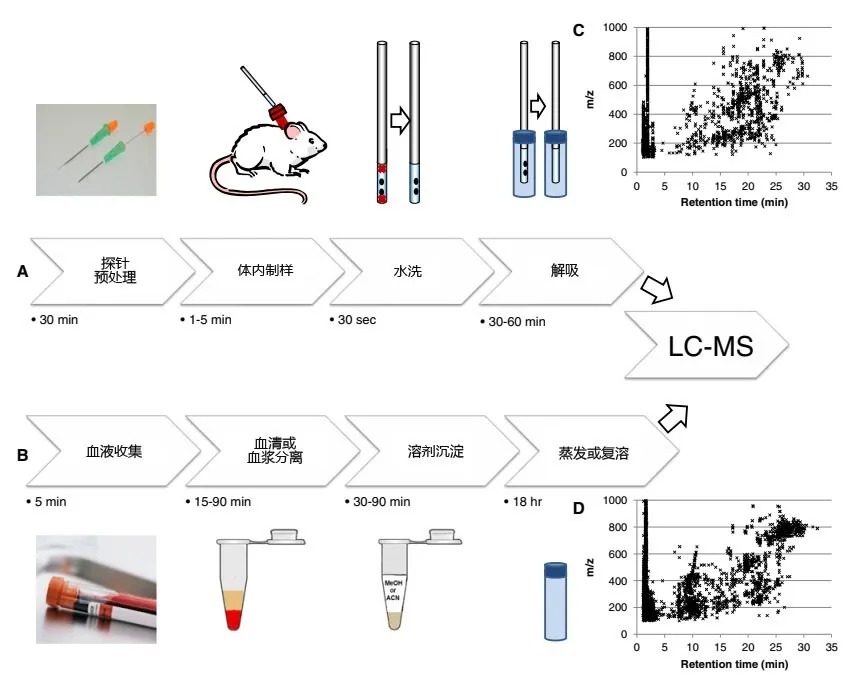
图19
(2)湍流色谱法(TFC)
TFC法允许直接将未经处理的血清注入到LC-MS中,因为TFC满足大颗粒(25-50um)和小粒径(0.5-1.0um)的条件,大分子物质不能保留,小分子可以被检测出来。TFC的潜在优势是高度量,高自动化和最小的样本处理,可以减少样本处理流程中外来污染物的引入和无意的样品流失。
图20总结了全代谢组学中所使用的各种提取方法,一般来说,在LC-MS的代谢组研究的平均标准偏差(RSD)在15%~20%,是个合理的目标,所以我们在做代谢组学时,需要理解所选择的方法的优缺点,以及考虑所得到数据的生物学解释。
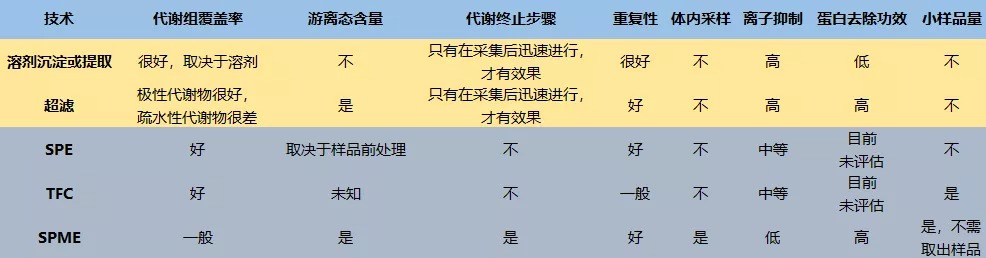
图20
四
代谢组学研究常见的10个问题
Q1:如何理解质谱检测的正负离子模式?
A:物质需要离子化后才能被质谱检测。根据化合物的性质,也就是结构的不同,有些物质在电离时容易带正电荷,有些容易带负电荷。例如,碱性化合物很容易加合质子,带正电荷,形成[M+H]+,m/z就是分子量加1,酸性化合物很容易丢失质子,带负电荷,形成[M-H]-,m/z就是分子量减一;当然,ESI不只是会形成加氢或减氢峰的,还有别的情况,正离子如:[M+Na]+,[M+K]+,[M+NH4]+...负离子如:[M+Cl]-,[M+HCOOH-H]-,[M+CH3COOH-H]-...已经是离子型的化合物,如季铵盐类,得到的就是M+,当样本浓度比较高时,还会产生二聚离子,如[2M+H]+,[2M+Na]+...ESI源还会形成多电荷离子,特别是在分子量较大的肽类化合物,如[M+nH]n+,[M-nH]n-...带正电荷的离子能在正离子模式下被检测到,而带负电荷的离子能在负离子模式下被检测到。所以,就非靶向代谢组学检测结果来说,两个模式下的检测结果都需要进行关注。
Q2:怎么理解PLS—DA模型及其参数?
A:PLS-DA是一种有监督的模式识别方法,即该方法需要事先确定样本的类型归属,可以最大程度地反映分类组别之间的差异,其分类判别能力要优于无监督模式识别方法,但通过主成分分析可以获得数据的可视化总览,而不受其他人为因素的影响。同时,通过计算PLS-DA模型中变量投影重要度(Variable Important for the Projection,VIP)来衡量各代谢物表达模式对各组样本分类判别的影响强度和解释能力,从而辅助代谢标志物的筛选(通常以VIP≥1.0 作为筛选条件)。
Q3:目前的主要代谢组技术有哪些?各有什么特点?
A:目前主要的代谢组技术平台主要有NMR(核磁共振)、GC-MS(气相色谱-质谱联用)、LC-MS(液相色谱-质谱联用)。
1) NMR技术具有无损伤性,无辐射性,无偏向性,方法灵活,处理简单等优点,但灵敏度较低,动态范围有限;
2) GC-MS技术具有高分辨率,高灵敏度,有比较标准的数据库,易于定性等优点,但需衍生化,预处理繁琐;
3) LC-MS技术具有灵敏度较高,较宽动态范围,无需衍生化等优点,但标准谱图库信息不全,不易定性。
Q4:QC样本的做法与意义。
A:QC样本是取等量制备好的实验样本混合而成,在上机时插入样本的前中后期,做仪器稳定性质控评估。例如,检测100个样品中代谢物质,在提取样品之后,从100个样品中各吸取等量样品,作为一个混和样品。随后,在100个样品的仪器分析的过程中,可在每20个样品跑样过程中插入检测一个混合样品,最后通过分析混样在前后五六次检测数据来判断仪器稳定性,并作为数据过滤的依据。
Q5:代谢组学研究需要多少生物重复?为什么?
A: 代谢物在不同组织样品中差异较大,为了可靠的统计学以及生物学分析:
1. 微生物与植物样本:每组建议8个样本,最少6个;
2. 模式动物类型样本:每组建议12个样本,最少8个;
3. 临床样本:每组建议100个样本,最少30个。
注:生物学重复越多越好
Q6:差异代谢离子的筛选标准是什么?
A: 代谢组学分析的主要目的是从检测到的大量代谢物中筛选出具有统计学和生物学意义的代谢物,并以此为基础阐明生物体的代谢过程和变化机制。由于代谢组学数据具有“高维、海量”的特点,因此需要用单维和多维的方法根据数据特性从不同角度进行分析。同时考量两类统计分析方法的结果,有助于我们从不同角度观察数据,得出结论,也可以帮助我们避免只使用一类统计分析方法带来的假阳性错误或模型过拟合。
Q7:metaboanalystinput表中的数值是标准化后的数值吗?这些数值的单位是什么?这些数值对应的物质怎么查找?
A:是标准化后的;一般是没有单位的;这些对应的mz可以在quant-identification表格中查找到。
Q8:如您想要做Q7和D7样本的两两比较,但合作公司只支持只有6个生物学重复及以上的组间进行两两比较,所以两个样本之间的两两比较无法进行?
A:是因为在做差异比较时需要绘制一幅图,但只有6个点及以上才能绘制出这幅图,也就是说如果溶血样本上机后发现有问题也不能剔除两个样本之后剩余四个进行差异比较。
Q9:在进行检测的时候是否有内源代谢物质做图谱对比?
A:谱图比对是基于理论二级谱图,所有的有一级鉴定结果,并能找到二级谱图的物质都会和它们的理论谱图进行比对。
Q10:C18的柱子不适合糖类及磷酸化的糖类物质,而检测结果中有糖类,这个结果可信度高吗?
A:C18的柱子确实不适合糖类检测,而检测到糖类物质可能和保留有关,常规来说糖类水溶性比较强,在反相柱不容易保留,但是这个不是绝对的,严格上说这个柱子不建议用来测糖类;可是反相柱的峰形之类的都比较好,使用一些修饰剂之类能使一些糖类保留,如果要针对某些物质,需要用标准品专门做测试才能确认。














